|
Forschung Scherthan Lab |
Forschungsgebiete:
Molekulare Cytologie,
Strahlenbiologie, DNA-Reparatur, Telomere,
Chromosomendynamik in der Meiose, Chromosomenevolution
Die meiotische Chromosomenpaarung
Eltern und ihre Kinder gleichen sich selten bis aufs Haar. Ein Grund hierfür ist die bei der sexuellen Fortpflanzung erfolgende Durchmischung und Neusortierung der Erbanlagen, die auf den elterlichen Chromosomen lokalisiert sind. Bevor aber Eizelle und Spermium miteinander verschmelzen, muss in beiden Eltern der Chromosomensatz halbiert werden, damit nicht jede Befruchtung zur weiteren Verdoppelung des Genoms führt. Diese speziellen Aufgaben, Vermischung der Erbanlagen und Halbierung des Chromosomensatzes, bewerkstelligt der Organismus durch zwei dicht aufeinanderfolgende Zellteilungen ohne dazwischengeschaltete DNA-Vermehrung. Diesen Vorgang nennt man Meiose. Eine unerlässliche Voraussetzung für die Reduktion des Chromosomensatzes und die Keimzellbildung ist die Längspaarung der väterlichen und mütterlichen Chromosomen (die Homologen) (Abb.1). Hierzu werden die zuvor meist getrennten Homologen in räumliche Nachbarschaft gebracht und durch eine Art speziellen Protein-Reißverschluss, den Synaptischen Complex (SC) miteinander verhaftet. Dieser Vorgang ist eine generelle Voraussetzung für die Trennung der elterlichen Chromsomen durch die Reduktionsteilung (Meiose I). In den meisten sich sexuell fortpflanzenden Organismen wird die Längspaarung dazu genutzt, um mittels Rekombinationsreparatur Stücke zwischen den elterlichen Chromosomen auszutauschen.
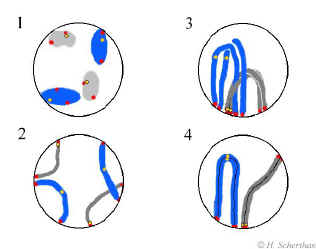 Abbildung 1: Schematische Darstellung der Homologenpaarung in der meiotischen Prophase. (1) Vor der Meiose sind die homologen
Chromosomen (zwei Paare: blau & grau) getrennt und nehmen im Zellkern
kompakte Territorien ein. Die Chromosomenenden (Telomere,
rot) und Zentromere (gelb)
sind über die Territorien und somit im Zellkern wahllos verteilt. (2) Zu Beginn
der Prophase I strecken sich die Chromosomen und heften mit ihren Telomeren an die Kernhülle an. Diese wandern an der
Kernhülle entlang und bilden (3) eine kurzlebige Ansammlung - das sog. chromosomale Bukett. Die Telomerbewegungen
ermöglichen es den Homologen sich durch molekulare Mechanismen zu erkennen und
zu paaren. (4) Die Längspaarung der Homologen wird durch eine
reißverschlussartige Proteinstruktur (den SC; schwarze Striche) stabilisiert.
Nach der Paarung und Rekombination wird der SC wieder aufgelöst und die
Homologen werden an den Zentromeren durch die Reduktionsteilung getrennt. (siehe Scherthan et
al. 1996 JCB)
Abbildung 1: Schematische Darstellung der Homologenpaarung in der meiotischen Prophase. (1) Vor der Meiose sind die homologen
Chromosomen (zwei Paare: blau & grau) getrennt und nehmen im Zellkern
kompakte Territorien ein. Die Chromosomenenden (Telomere,
rot) und Zentromere (gelb)
sind über die Territorien und somit im Zellkern wahllos verteilt. (2) Zu Beginn
der Prophase I strecken sich die Chromosomen und heften mit ihren Telomeren an die Kernhülle an. Diese wandern an der
Kernhülle entlang und bilden (3) eine kurzlebige Ansammlung - das sog. chromosomale Bukett. Die Telomerbewegungen
ermöglichen es den Homologen sich durch molekulare Mechanismen zu erkennen und
zu paaren. (4) Die Längspaarung der Homologen wird durch eine
reißverschlussartige Proteinstruktur (den SC; schwarze Striche) stabilisiert.
Nach der Paarung und Rekombination wird der SC wieder aufgelöst und die
Homologen werden an den Zentromeren durch die Reduktionsteilung getrennt. (siehe Scherthan et
al. 1996 JCB)
Es ist offensichtlich, dass
die Bildung und Ausdifferenzierung einer großen Zahl von Keimzellen einen
komplexen Mechanismus darstellt, der in mehrzelligen Organismen in speziellen
Organen, so z.B. bei den Säugetieren in Testes und Ovarien, abläuft. Wird die
Keimzellbildung durch Inaktivierung wichtiger Gene oder chemische Noxen
gestört, kann dies zur Unfruchtbarkeit führen. So spielen genetische Defekte in
der männlichen Keimzelldifferenzierung bei ungefähr 30% aller infertilen Männer
eine Rolle.
Unsere Arbeitsgruppe
untersucht den Mechanismus der Homologenpaarung vergleichend in der Meiose des
Menschen, der Nagetiere und Hefen. Hierbei analysieren wir evolutiv entfernt
verwandte Spezies und ihre Mutanten, um konservierte und somit bedeutsame
Motive im Chromosomenpaarungsmechanismus identifizieren zu können. Besonderes
Interesse gilt dabei den Chromosomenenden, den Telomeren,
die eine bedeutende Schutzfunktion für die Stabilität des Genoms haben und in
der Meiose eine beispiellose, in somatischen Gewebszellen unbekannte
Umverteilung und Beweglichkeit zeigen (Abb.1). In der Methodik bedienen wir uns
molekular-zytologischer Methoden wie z.B. der Fluoreszenz-in situ-Hybridisierung
(FISH) in Kombination mit Immunofluoreszenz,
wobei wir meiose-spezifische
Proteine sowie ganze Chromosomen oder bedeutsame Chromosomenabschnitte in
intakten Zellkernen anfärben und damit die Chromosomenpaarung in der
Keimzelldifferenzierung darstellen (Abb. 2) und so auf Abnormalitäten untersuchen können.
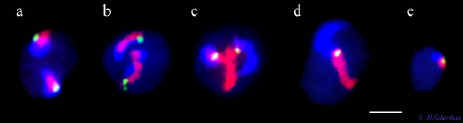 Abbildung 2: Darstellung der Paarung der homologen Chromosomen 3 in der Meiose des
Menschen mittels mehrfarben-FISH. Die Centromere sind
grün, die kurzen Arme blau und die langen Arme rot markiert. Die Umrisse der
Zellkerne sind in dunkelblau zu erkennen. (a) Prämeiotischer
Kern mit kompakten, getrennten Chromosomenterritorien. Hierbei ist auch die DNA
der Arme getrennt. (b) Leptotän-Stadium der meiotischen Prophase: die Chromosomen sind ausgestreckt.
(c) Zygotän: Die Homologenpaarung hat an den langen
Armen begonnen. Die Centromere und kurzen Arme sind
noch getrennt. (d) Pachytän: in diesem Stadium ist
nur noch ein dicker Chromosomenfaden zu sehen, da nun die Längspaarung
vollzogen ist. Dies gilt auch für die anderen 22 Chromosomenpaare die hier
nicht dargestellt sind. (e) Kondensierter Kern eines haploiden Spermiums, der
nach den beiden meiotischen Teilungen nur noch je ein
Chromosom enthält. Maßstab: 5µm. (siehe Scherthan et al. 1998 JCS)
Abbildung 2: Darstellung der Paarung der homologen Chromosomen 3 in der Meiose des
Menschen mittels mehrfarben-FISH. Die Centromere sind
grün, die kurzen Arme blau und die langen Arme rot markiert. Die Umrisse der
Zellkerne sind in dunkelblau zu erkennen. (a) Prämeiotischer
Kern mit kompakten, getrennten Chromosomenterritorien. Hierbei ist auch die DNA
der Arme getrennt. (b) Leptotän-Stadium der meiotischen Prophase: die Chromosomen sind ausgestreckt.
(c) Zygotän: Die Homologenpaarung hat an den langen
Armen begonnen. Die Centromere und kurzen Arme sind
noch getrennt. (d) Pachytän: in diesem Stadium ist
nur noch ein dicker Chromosomenfaden zu sehen, da nun die Längspaarung
vollzogen ist. Dies gilt auch für die anderen 22 Chromosomenpaare die hier
nicht dargestellt sind. (e) Kondensierter Kern eines haploiden Spermiums, der
nach den beiden meiotischen Teilungen nur noch je ein
Chromosom enthält. Maßstab: 5µm. (siehe Scherthan et al. 1998 JCS)
So gelang uns erstmalig der Nachweis, dass die
Umgruppierung der Telomere in der frühen meiotischen Prophase der Bäckerhefe Saccharomyces
cerevisiae starke Homologien zur Bukettbildung in der Meiose der Maus, der Ratte und des
Menschen aufweist (Abb. 3), und, dass die Telomeransammlung
im Bukett ein Aktin-abhängiger Prozess ist. Dabei darf man nicht vergessen, dass die Hefe
nicht nur bei der Brot- und Bierherstellung eine (auch wirtschaftlich) wichtige
Rolle spielt, sondern auch eine der am besten untersuchten genetischen
Modellspezies ist.
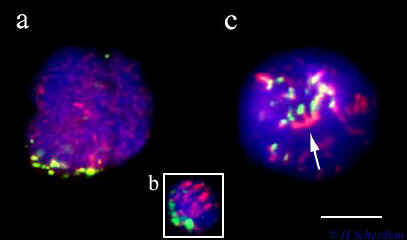 Abbildung 3:
Darstellung von Telomersequenzen (grün) und
SC-Proteinen (rot) in Meiozyten-Kernen im Bukettstadium (Telomeransammlung).
(a) Ratte, (b) Hefe und (c) Atm-Mutante der
Maus (Kern-Oberseite dargestellt). Normalerweise finden sich in Zellkernen mit Bukettbildung feine Fäden der SC-Proteine (a). In der Atm-Mutante sind die Fäden dick und vernetzen
mehrere Enden fälschlicherweise quer (Pfeil). Maßstab für a,b,c:
5µm. (siehe Scherthan
2001 NRMCB)
Abbildung 3:
Darstellung von Telomersequenzen (grün) und
SC-Proteinen (rot) in Meiozyten-Kernen im Bukettstadium (Telomeransammlung).
(a) Ratte, (b) Hefe und (c) Atm-Mutante der
Maus (Kern-Oberseite dargestellt). Normalerweise finden sich in Zellkernen mit Bukettbildung feine Fäden der SC-Proteine (a). In der Atm-Mutante sind die Fäden dick und vernetzen
mehrere Enden fälschlicherweise quer (Pfeil). Maßstab für a,b,c:
5µm. (siehe Scherthan
2001 NRMCB)
Um weitere Einblicke in die Mechanismen der Meiose und
Rolle meiotischer Telomere für die Fertilität zu bekommen, untersuchen wir
die Zellkernarchitektur
und Homologenpaarung in der Meiose von Mutanten der Hefe und Maus und wollen
damit die genetische Regulation der meiotischen Telomerbewegungen sowie deren Interaktion mit der
DNA-Reparatur und Homologenpaarung aufklären. So konnten wir u.a. im Mausmodell
zeigen, dass eine Mutation im Atm-Gen,
dessen Funktionsverlust beim Mensch die Erbkrankheit Ataxia telangiectatica
auslöst, zur fehlerhaften Telomer- und
Chromosomenverteilung (Abb. 3c) in der Keimzelldifferenzierung führt. Ähnliche
Befunde wurden von uns in der Meiose von Mäusen gemacht, denen das Histon H2AX fehlt. Histon H2AX spielt auch eine
wichtige in der DNA-Reparatur. In der Hefe S. cerevisiae
konnten wir mit NDJ1 ein meiotisches Telomer-Protein
identifizieren können, das für den Eintritt in die Bukettbildung benötigt wird, wohingegen scREC8 (eine Cohesin-Komponente) den Austritt aus den Bukettstadium reguliert. Differentielle Minor- und
Major-Satelliten-DNA FISH und Immunfärbung zeigte, dass heterochromatische perizentrischen Chromosomenregionen von der allgemeinen Homologiesuche im Leptotän
ausgenommen werden und ihre Paarung im Bukettstadium
durch die intensive Telomer-Aggregation
bewerkstelligt wird. Während in höheren Organismen und der Spalthefe die meiotische Chromosomenbewegungen durch Mikrotubuli
getrieben werden, stellt sich in der Bierhefe die für die Bukettbildung nötige Aggregation und Dispersion von Telomeren entlang der meiotischen
Kernhülle dabei als Aktin-abhängiger Prozess dar.
Hemmstoffversuche und Lebendzellmikrokopie zeigten, dass der Aktin-Mechanismus der meiotischen
Telomerbewegung in
Verbindung mit scNDJ1 essentiell für die dramatischen
Chromosomen-Bewegungen ist, die in meiotischen
Hefezellen während der Prophase I ablaufen und vermutlich die Homologenpaarung
unterstützen.
In weiteren Forschungen untersuchen wir u.a. strahleninduzierte
DNA-Schäden (DNA Doppelstrangbruch-Foci)
in unterschiedlichen Zelltypen des Menschen und der Säuger und ihre Eignung als
Biodosimeter zur Rekonstruktion von akzidentellen Strahlenexpositionen. Unsere
Strahlen-Forschung in den Modellspezies Spalt- und Bäckerhefe konnten jüngst
eine hohe Empfindlichkeit der Aktin-getriebenen
Chromosomenbewegungen der Bäckerhefe gegenüber Umweltstressoren wie
ionisierende Strahlung (IR) und Sauerstoffradikale aufdecken. Im Gegensatz dazu
zeigte sich das Zytoskelett in der Meiose der
Spalthefe durch starke antioxidative
Schutzmechanismen gegenüber Umweltstressoren wie IR resistent. Die
zugrundeliegenden Mechanismen werden in weiteren Arbeiten untersucht.
Note: the images on this page may only be used with
consent of the author. v 4/16.